2018年には、遺伝子ドライブにより実験室でマラリアを媒介する蚊を絶滅させることに成功したとの論文が発表されています。
さまざまな応用が期待される一方で、生物種全体を遺伝的に改変することに対する懸念も大きいようです。誤って実験室から野外に遺伝子ドライブが流出した場合、生態系全体に広く影響をもたらす危険性も指摘されています。
2019年1月に英科学誌「eLife」に掲載されたJackson Champer氏らの研究では、研究室で安全に遺伝子ドライブの実験を行うための予防的対策として、2つの分子的手法を推奨しているようです。
遺伝子ドライブとは?
参考動画:CRISPR遺伝子ドライブの立役者の一人、Kevin Esvelt氏が遺伝子ドライブの原理や応用可能性・潜在的な危険性などについてわかりやすく解説。(英語のみ)
遺伝子ドライブとは、通常のメンデル遺伝よりも高い確率で遺伝するシステムのこと。近年、CRISPR/Cas9のような革新的なゲノム編集技術が出現したため、遺伝子ドライブを応用することで、特定の遺伝子を集団中に急速に広められる可能性があります。
たとえば、マラリアなどの病気を媒介する蚊の野外個体群に病気の伝達を防ぐ遺伝子を広めたり、病気を媒介する蚊そのものの数を減らしたり、外来侵入種や農業害虫の駆除したりなど、さまざまな応用可能性が期待されています。
ニュージーランド政府は、2050年までにネズミなどの外来種を根絶する計画「Predator Free 2050」を発表しており、その中で遺伝子ドライブの利用を検討しているようです。
※遺伝子ドライブの基本原理については、次の記事でも詳しく説明しています。
参考動画 “New Zealand sets target to make country ‘predator-free’ by 2050″(CGTN):ニュージーランド政府は2050年までに外来種の根絶を目指しており、その政策の中で遺伝子ドライブの利用を検討している。(英語のみ)
遺伝子ドライブの課題
遺伝子変換効率には、大きなばらつきがある
CRISPRによる遺伝子ドライブがある程度機能することは、酵母、ハエ、蚊などですでに実証されているようです。しかし、その遺伝子の変換効率には大きなばらつきがある(出芽酵母で100%近く、キイロショウジョウバエで19~62%、ハマダラカで87~99%)ようです。このように変換効率がばらつく原因としては、Cas9発現のレベルやタイミング、ターゲットとする遺伝子、組み換え率などいくつかの要因が考えられるとのことです。
遺伝子ドライブに対する抵抗性
遺伝子ドライブに変換できない「抵抗性」遺伝子がしばしば形成されることも、大きな問題のようです。遺伝子変換効率と同様、抵抗性遺伝子の形成率にも対象生物や遺伝子ドライブのシステムによって大きなばらつきがみられるとのことです。
【関連記事】
⇒ CRISPR/Cas9遺伝子ドライブに「抵抗性」の壁ー最新研究【マラリア解説動画あり】
マラリアを媒介するハマダラカの一種Anopheles gambiae(credit: CDC/James Gathany, public domain)
変換効率や抵抗性の問題に対する解決策
これらの問題には、すでに以下のような対策が考えられているようです。
・隣接領域をターゲットとする複数のガイドRNAの使用(gRNA multiplexing)
・プロモーターの改善
・ターゲット領域の注意深い選択
こうした解決策の有効性を実証した研究もあるようです(以下参照)。
遺伝子ドライブの実験における成功例
実験室で蚊の「絶滅」に成功
2018年には、実験室内のケージで遺伝子ドライブによって、マラリアを媒介するハマダラカを絶滅させることに成功したことを報告する論文が発表されています。抵抗性の問題を乗り越えて、メスを不妊にする遺伝子ドライブが集団中に広がることによって、わずか7~11世代で蚊の集団は絶滅したようです。
参考動画 ”Genetic Engineering of Mosquitoes Spurs New Hope in Malaria Fight” (VOA News):実験室のケージ内で、遺伝子ドライブを利用してハマダラカの絶滅に成功(英語のみ)。
遺伝子ドライブを哺乳類(マウス)に適用することに成功
2019年には、遺伝子ドライブを実験室でマウスへ適用することに成功したことを報告する論文が発表されています。
参考動画:哺乳類であるマウスへの遺伝子ドライブの適用を報告した論文の概要について解説している。(カリフォルニア大学)
遺伝子操作した蚊を野外に放つブラジルの実験は事実上失敗か
遺伝子を操作して優性致死遺伝子を組み込んだネッタイシマカの雄を大量に放つブラジルの大規模な野外実験では、個体数を一時的に減らすことはできたものの、その後ほぼ元の水準に戻ってしまったようです。
改変遺伝子自体は野生個体群に組み込まれてしまっており、予期せぬ影響も懸念されるため、今後は慎重なモニタリングが必要だろうとのことです。(Evans et al., 2019 )
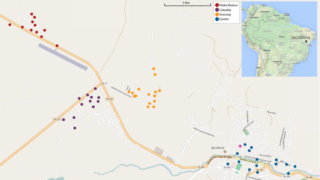
※こちらは遺伝子ドライブそのものの実験ではありません
遺伝子ドライブの危険性
遺伝子ドライブにはこのような進展が見られる一方で、実際に野外で遺伝子ドライブを応用した際にどのような結果になるかについては、大きな懸念があるようです。
遺伝子ドライブ自体が「新しい強力な侵入種」になりうる
ある集団中に遺伝子ドライブが侵入するには、ごく少数の遺伝子ドライブ個体を導入するだけで十分である可能性が指摘されています。そのため、その集団が絶滅する前に、遺伝子ドライブが別な大陸や島に侵入してしまうリスクがあるようです。また、ネズミなどの害獣がもたらす経済的損失の大きさを考えると、一部の人間が故意に遺伝子ドライブ個体を他の場所へ移動させる可能性も非常に高いと言えます。つまり遺伝子ドライブ自体が新しい強力な侵入種となり、各地に広がって生態系を改変してしまう危険性があるようです。
遺伝子ドライブの新たな安全対策
遺伝子ドライブ個体が誤って実験室から野外に流出した場合は、ごく少ない個体数であっても、自然の生態系に遺伝子ドライブが広がってしまう恐れがあります。現在の安全対策は主に物理的な閉じ込めに頼っていますが、ヒューマンエラーなどを考慮すると必ずしも万全とはいえないようです。そこでJackson Champer氏らは、分子メカニズムによる2つの安全対策を推奨しています。
①遺伝子ドライブのターゲットとして、野生型には存在しない遺伝子領域を合成する(synthetic target site drive, ターゲット配列が実験室内の系統にしか存在しない)
②DNA切断に必要なエンドヌクレアーゼを遺伝子ドライブとは別な場所に組み込む(split drive、Cas9とガイドRNAを分離)※「デイジードライブ」とも呼ばれている遺伝子ドライブです。
デイジードライブの詳細については次の記事をご覧ください。
⇒ 自然消滅型の新・遺伝子ドライブ「デイジードライブ」とは?ー無限拡散の危険対策
どちらの場合も、それぞれ実験室内の系統がいない野外環境では、効率的に遺伝子ドライブが機能しないと考えられ、安全対策(遺伝子ドライブの封じ込め策)として期待できるようです。
関連動画:遺伝子ドライブの安全対策を解説。上記2つに加え、③「元に戻せる遺伝子ドライブ」 (reversible gene drive)にも言及されています。
【管理人チャールズの感想】
非常に強力なツールである遺伝子ドライブは、使い方次第で人々に多大な恩恵をもたらしうる一方、取り返しのつかない結果を引き起こす可能性もあります。どんなテクノロジーについても言えることだと思いますが、まずはできるだけ多くの人が関心を持って議論に参加していくことが大切でしょう。ゲノム編集の技術全般を含めて、今後も注目していきたいと思います。
【関連記事】
⇒ 遺伝子ドライブとは?原理・メカニズムの要点を簡潔に説明(動画・図説あり)
⇒ CRISPR/Cas9遺伝子ドライブに「抵抗性」の壁ー最新研究【マラリア解説動画あり】
⇒ 自然消滅型の新・遺伝子ドライブ「デイジードライブ」とは?ー無限拡散の危険対策
⇒ ゲノム編集・CRISPRとは?図や動画でわかりやすく簡単に原理・応用例や倫理的問題を解説




コメント